- En esta entrada teórica vamos a tratar los materiales metálicos que mas vamos a utilizar.
- INDICE:
Tipos de enlaces químicos (definición, tipos, características generales);
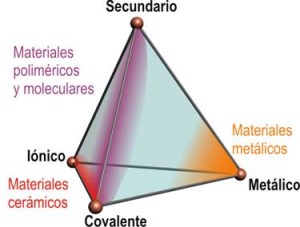
El enlace metálico (en profundidad);
Características de los materiales metálicos;
Metalografía:
Materiales metálicos:

- Estructura microscópica de los metales:
- Grano;
- Cristal;
- Tipos de cristales más habituales;
- Clasificación por densidad e importancia industrial;
- El Acero; (descubrimiento, procedencia mineralógica del hierro, importancia histórica, características, propiedades más significativas, estructuras cristalográficas, colores del acero en función de la temperatura)
- El aluminio; (descubrimiento, procedencia mineralógica, características, propiedades más significativas, estructura cristalográfica).
TIPOS DE ENLACES QUIMICOS
- Los enlace químico son las interacciones físicas , responsables del intercambio de electrones que ocurren entre los átomos, moléculas e iones. En este proceso de interacción física se producen transferencia de electrones entre los átomos participantes, cabe destacar que las moléculas, cristales y gases diatómicos forman la mayor parte del ambiente físico que nos rodea.
- Para que se produzca un enlace los átomos deben de ceder, aceptar o compartir electrones. Las cargas opuestas se atraen ya que al estar unidas adquieren mayor estabilidad, esta mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho.
- Ahora veremos que los tipos de enlaces se dividen en:
- PRIMARIOS. Estos producen los enlaces químicos que mantienen a los átomos unidos y se dividen en:
- ENLACE IÓNICO O ELECTROVALENTE
- ENLACE COVALENTE
- ENLACE METÁLICO
- SECUNDARIOS. Son subdivisiones de los enlaces y se consideran mas débiles tenemos a:
- ENLACE DE HIDRÓGENO
- ENLACE DE VAN DER WAALS
- ENLACE ELECTROVALENTE
- Es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, uno altamente electropositivo (baja energía de ionización) y otro altamente electronegativo (alta afinidad electrónica), haber dicho de otra manera, los elementos involucrados aceptan o pierden electrones (un catión y un anión). No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad pero una diferencia de 1.7
Un enlace covalente es la unión de átomos donde se da un compartimiento de uno o mas electrones del último nivel para alcanzar el octeto estable a excepción de el Hidrógeno que alcanza la estabilidad cuando tiene dos electrones, para que se genere este tipo de enlace es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7. Los enlaces covalentes se producen entre átomos de un mismo elemento no metal y entre distintos elementos no metales, otra característica por ejemplo entre dos átomos no metálicos pueden compartirse uno, dos o tres pares de electrones, esto dará lugar a la formación de un enlace simple, doble o triple respectivamente.
- ENLACE METÁLICO
Es un enlace químico que mantiene unidos los átomos de los metales entre si (union entre núcleos atómicos y los electrones de valencia),en este tipo de estructuras cada átomo metálico esta dividido por otros doce átomos (6 en el mismo plano, 3 por encima y 3 por debajo), la estructura de este enlace es muy compacta ya que los átomos se agrupan de forma muy cercana unos a otros interaccionando sus núcleos junto con sus nubes electrónicas, otra característica de los metales es la elevada conductividad eléctrica y térmica por los electrones libres que presenta ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica.
- ENLACES SECUNDARIOS
Dentro de este tipo de enlace tenemos:
- ENLACE DE HIDRÓGENO. Son los mas comunes en las moléculas con enlace covalente que contengan hidrógeno, estos se producen entre átomos covalentes y oxigenados llevando cargas eléctricas muy pequeñas alrededor del enlace de hidrógeno y cargas negativas alrededor de los enlaces oxigenados.
ENLACE DE VAN DER WAALS. Es una fuerza débil de atracción que puede existir entre los átomos y las moléculas, a este enlace s debe la condensación de los gases nobles y de las moléculas con enlaces químicamente para formar líquidos y sólidos a temperaturas bajas. Este tipo de enlace es semejante al iónico, esto es por atracción de cargas opuestas, la diferencia clave es que no se transfieren electrones, la atracción depende de las atracciones asimétricas de carga positiva y negativa dentro de cada unidad atómica o molecular que se enlaza. El enlazamiento secundario puede ser de dos tipos según los dipolos temporales, permanentes.
ENLACE METALICO EN PROFUNDIDAD
es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
El enlace metálico se produce cuando se combinan metales entre sí. Los átomos de los metales necesitan ceder electrones para alcanzar la configuración de un gas noble. En este caso, los metales pierden los electrones de valencia y se forma una nube de electrones entre los núcleos positivos.
El enlace metálico se debe a la atracción entre los electrones de valencia de todos los átomos y los cationes que se forman.
Este enlace se presenta en el oro, la plata, el aluminio, etc. Los electrones tienen cierta movilidad; por eso, los metales son buenos conductores de la electricidad. La nube de electrones actúa como "pegamento" entre los cationes. Por esta razón casi todos los metales son sólidos a temperatura ambiente.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones des localizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
CARACTERISTICAS DE LOS MATERIALES METALICOS
- Los materiales metálicos tienen una serie de características:
- Los materiales metálicos tiene mucha capacidad de reflejar, o lo que es lo mismo su brillo.
- Son buenos conductores de electricidad.
- Son muy densos y pesados.
- Maleabilidad.
- Resistencia mecánica.
- Ofrecen poca resistencia al rayado.
METALOGRAFIA
- Es la rama de la metalurgia que estudia la estructura de un metal-aleación y la relaciona con la composición química, con las propiedades mecánicas y físicas. Este estudio es llevado a cabo con la aplicación de diversas y variadas técnicas especiales. En los comienzos de la metalurgia, se utilizaron para conocer las propiedades físicas y mecánicas de los materiales, los análisis químicos y los ensayos mecánicos. Con estos métodos no quedaba definido completamente el metal o la aleación, con la aparición de la metalografía comenzó una información muy valiosa que se refiere a la forma y tamaño del grano, conformación de los constituyentes capaces de ejercer gran influencia sobre la dureza, resistencia a la tracción resiliencia, fatiga, etc., los cuales pueden ser modificados por los tratamientos térmicos o conformación mecánica. La metalografía no reemplaza a los métodos anteriormente enunciados, sino que se complementan entre sÌ. En el campo de los tratamientos térmicos, encuentra un amplio campo de aplicación, determinando el metalografo una falla producida en una pieza en servicio o un temple mal realizado. Dentro de este método esta la macrografia en la cual se puede observar un defecto o la orientación de las fibras del material según su laminación o forjado. Entre la macrografía y micrografía existe una diferencia entre las dos en la observación en el microscopio, en la primera se utiliza hasta 10 aumentos y en la segunda desde 50 hasta 1000 aumentos.
ESTRUCTURA MICROSCOPICA DE LOS METALES
- ahora vamos a tratar en mas detalle la estructura interna de los metales.
- GRANO: El tamaño de grano tiene considerable influencia en las propiedades mecánicas de los metales y aleaciones.Los límites de grano, son el lugar en que ocurren, preferentemente, las reacciones en estado sólido. En general, la energía libre de una cantidad de masa de metal dada disminuye a medida que aumenta el tamaño de grano. La causa del cambio de energía es la disminución de la energía interfacial asociada a los límites de grano. Esta disminución de energía es la fuerza impulsora que tiende a producir el crecimiento del grano, Ahora bien, en la mayoría de las condiciones de aplicación de los metales, la velocidad de crecimiento del grano es muy pequeña, y sólo a temperaturas elevadas el crecimiento se produce rápidamente.
- ESTRUCTURA CÚBICA CENTRADA EN LAS CARAS . Es una estructura que caracterizan por tener ocho átomos, distribuidos en cada uno de sus vértices y estos forman un cubo, además de tener un átomo central en cada cara del cubo.
-ESTRUCTURA CÚBICA CENTRADA EN EL CUERPO (BCC). Estructura formada por ocho átomos distribuidos en sus vértices que a su vez de alguna manera encierran a un átomo en el centro del cubo.
-ESTRUCTURA EXAGONAL COMPACTA (HCP). Los átomos de esta estructura se distribuyen de forma hexagonal ubicándose en cada vértice, además de tres átomos centrales y uno en cada cara.
MATERIALES METALICOS
- Vamos a tratar en este apartado, las materias primas de los materiales metálicos. Es imposible encontrar materias primas naturales puros ya que están en contacto con agua, oxigeno o con otros metales. A pesar de eso podemos encontrar metales llamados puros en la naturaleza como la plata o el oro. También podemos encontrar aleaciones de diferentes metales para mejorar sus propiedades.
CLASIFICACION POR DENSIDAD E IMPORTANCIA INDUSTRIAL
- La densidad es una unidad de medida que mide la cantidad de masa en un determinado volumen de una sustancia. Los materiales metálicos son muy densos.
- Los materiales metálicos se dividen en:
- Metales Ferrosos:
Magnesio
Cromo
Níquel
Cobalto
Hierro
- Metales no ferrosos:
Cobalto
Cobre
estaño
- IMPORTANCIA DE LOS METALES INDUSTRIALMENTE.
Existen metales que el hombre ha utilizado desde la antigüedad, como el hierro, el cobre, el estaño, el plomo, etc., sin embargo, los metales se empezaron a utilizar con mayor frecuencia a partir de la Revolución Industrial (Gran Bretaña, a fines del siglo XVIII).
Uno de los metales de mayor importancia es el hierro (más del 80 % del peso metálico industrial), que con otros que se alean con él, forman los metales ferroaleables, necesarios para la producción de los diversos aceros.
Uno de los metales de mayor importancia es el hierro (más del 80 % del peso metálico industrial), que con otros que se alean con él, forman los metales ferroaleables, necesarios para la producción de los diversos aceros.
- EL ACERO:
El Acero es básicamente una aleación o combinación de hierro y carbono (alrededor de 0,05% hasta menos de un 2%). Algunas veces otros elementos de aleación específicos tales como el Cr (Cromo) o Ni (Níquel) se agregan con propósitos determinados.
Ya que el acero es básicamente hierro altamente refinado (más de un 98%), su fabricación comienza con la reducción de hierro (producción de arrabio) el cual se convierte más tarde en acero.
El hierro puro es uno de los elementos del acero, por lo tanto consiste solamente de un tipo de átomos. No se encuentra libre en la naturaleza ya que químicamente reacciona con facilidad con el oxígeno del aire para formar óxido de hierro - herrumbre. El óxido se encuentra en cantidades significativas en el mineral de hierro, el cual es una concentración de óxido de hierro con impurezas y materiales térreos.
Ya que el acero es básicamente hierro altamente refinado (más de un 98%), su fabricación comienza con la reducción de hierro (producción de arrabio) el cual se convierte más tarde en acero.
El hierro puro es uno de los elementos del acero, por lo tanto consiste solamente de un tipo de átomos. No se encuentra libre en la naturaleza ya que químicamente reacciona con facilidad con el oxígeno del aire para formar óxido de hierro - herrumbre. El óxido se encuentra en cantidades significativas en el mineral de hierro, el cual es una concentración de óxido de hierro con impurezas y materiales térreos.
Las propiedades del acero son las siguientes:
Resistencia al desgaste: Es la resistencia que ofrece un material a dejarse erosionar cuando esta en contacto de fricción con otro material.
Tenacidad: Es la capacidad que tiene un material de absorber energía sin producir Fisuras (resistencia al impacto).
Maquinabilidad: Es la facilidad que posee un material de permitir el proceso de mecanizado por arranque de viruta.
Dureza: Es la resistencia que ofrece un acero para dejarse penetrar. Se mide en unidades BRINELL (HB) ó unidades ROCKWEL C (HRC), mediante test del mismo nombre.
- EL ALUMINIO: El aluminio es un metal no férreo que comenzó utilizándose en la antigüedad en tintorería y medicina, con la forma de una sal doble conocida como "lumbre" que se sigue usando hoy en día. Conforme fueron pasando los años y con el desarrollo de la física y química en el año 1825, el físico danés Hans Christian Orsted, descubridor del electromagnetismo logro aislar por electrólisis unas primeras muestras pero bastante impuras, no fue hasta pasado dos años que se consiguió su aislamiento total por Friedrich Wöhler.Los estudios posteriores demostraron que el aluminio era un elemento abundante pero su extracción a partir de las rocas fue una tarea ardua, tanto así que en el siglo XIX, la producción era tan costosa que el aluminio llegó a considerarse un metal exótico de elevado precio y tan o mas preciado que la plata y el oro.
- Características del aluminio:
FÍSICAS. Comencemos diciendo que es un elemento muy abundante en la naturaleza, solo por detrás del oxígeno. Es un metal ligero con una densidad de 2700 kg/m cúbicos , tienen un bajo punto de fusión 660º C, es de color blanco y refleja bien la radiación electromagnética, buen conductor eléctrico y térmico.
MECÁNICAS. Es un metal blando y maleable, resistencia a tracción en estado puro de 160-200 N/mm cuadrado. Adecuado para la fabricación de cables eléctricos y láminas, pero no como elemento estructural, para mejorar estas propiedades se aléa con otros metales lo que permite realizar sobre el operaciones de fundición o forja así como la extracción del metal.
QUÍMICAS. La capa de valencia del aluminio cuenta con tres electrones, su estado de oxidación es tres, reacciona con el oxígeno formando una fina capa gris mate de alúmina que recubre el material aislándolo de corrosiones, el aluminio se disuelve con ácidos y bases. Reacciona con facilidad con el ácido clorhídrico y el hidróxido sódico.
PROPIEDADES DEL ALUMINIO
- Es buen conductor de la electricidad.
- Es un material maleable.
- Ligero.
- Punto de ebullición alto 2450º C.
- Tiene un color blanco, refleja bien la radiación electromagnética del espectro visible y el térmico.
- Con esto acabo la entrada de introducción a los materiales metálicos.








No hay comentarios:
Publicar un comentario